A LumiraDx, empresa de diagnóstico focada em Point of Care Testing (POCT), anunciou em 19 de agosto de 2020, que recebeu a Autorização de Uso de Emergência (EUA) do Food and Drug Administration nos EUA (FDA) para o LumiraDx SARS-CoV -2 teste de antígeno , que ajudará a enfrentar o desafio global de fornecer testes COVID-19 rápidos e econômicos em ambientes de cuidados comunitários.
O teste detecta a proteína do nucleocapsídeo do antígeno em um esfregaço nasal com resultados em menos de 12 minutos da aplicação da amostra em pacientes sintomáticos. Em estudos clínicos, o teste de antígeno LumiraDx SARS-CoV-2 demonstrou 97,6% de concordância positiva em relação ao PCR em pacientes testados em até 12 dias do início dos sintomas, tornando-o o teste de antígeno mais sensível e mais rápido atualmente disponível comercialmente.
Além do teste de antígeno, o teste de anticorpo LumiraDx SARS-CoV-2 , para uso com a Plataforma LumiraDx, será submetido em breve ao FDA para análise da EUA.
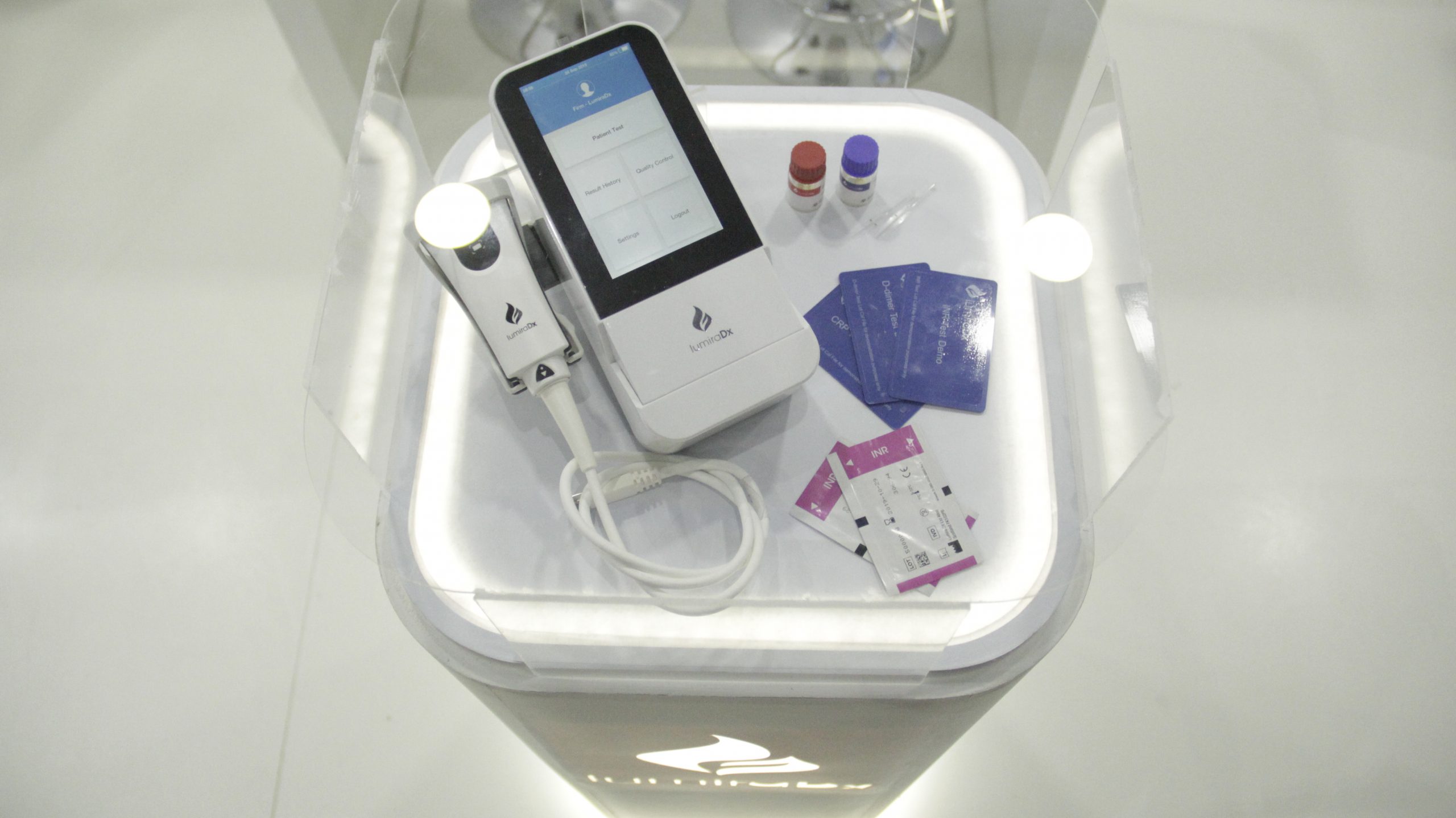
Plataforma LumiraDx – Point of Care de alta sensibilidade
A Plataforma LumiraDx, simplifica, reduz a escala e integra técnicas usadas em analisadores de laboratório para fornecer testes de diagnóstico comparáveis em laboratório em um único instrumento de ponto de atendimento que pode ser facilmente usado em ambientes de atendimento comunitário.
A plataforma consiste em um pequeno instrumento portátil; tira de teste microfluídica; fluxo de trabalho simples e padronizado; e conectividade digital segura e contínua para os sistemas de TI hospitalares e em nuvem.
É projetado para oferecer:
- Desempenho comparável em laboratório no ponto de atendimento em minutos
Cada teste é desenvolvido e validado em relação ao seu respectivo padrão de referência de laboratório, que acreditamos dar aos profissionais de saúde o benefício de desempenho comparável em laboratório e resultados em tempo real.
- Amplo menu de testes em um único instrumento
A plataforma LumiraDx oferece o teste INR (International Normalized Ratio) para o gerenciamento de pacientes com anticoagulação na Europa sob a marca CE. A empresa possui um pipeline de mais de 30 ensaios em doenças cardiovasculares, infecciosas, diabetes e distúrbios de coagulação com capacidade para executar imunoensaios, química, tecnologias moleculares e outras, bem como vários tipos de amostra usando uma única plataforma e fluxo de trabalho.
- Baixo custo
O instrumento LumiraDx visa reduzir o custo por teste, oferecendo uma variedade de tiras de teste de baixo custo em um único instrumento e economias associadas, incluindo custo reduzido de treinamento, manutenção e suprimentos.
- Garantia de alta qualidade– A plataforma realiza mais de 30 verificações de qualidade durante sua operação, com desempenho referenciado a métodos laboratoriais padrão.
Para obter acesso ao anúncio completo citado acima, acesse o link https://www.lumiradx.com/us-en/news-events/lumiradx-receives-fda-uae-for-poc-covid-19-ag-test